PENDAHULUAN
1.1 Latar Belakang
Semua makhluk hidup di bumi ini butuh air. Air merupakan pelarut yang sangat baik, sehingga di alam umumnya berada dalam keadaan tidak murni. Air alam mengandung berbagai jenis zat, baik yang larut maupun yang tidak larut serta mengandung mikroorganisme. Jika kandungan bahan-bahan dalam air tersebut tidak mengganggu kesehatan, air dianggap bersih dan layak untuk diminum, air dikatakan tercemar jika terdapat gangguan terhadap kualitas air sehingga air tersebut tidak dapat digunakan untuk tujuan penggunaannya. Pencemaran air dapat terjadi karena masuknya makhluk hidup, zat, dan energi terdalam air oleh kegiatan manusia. Keadaan itu dapat menurunkan kualitas air sampai ke tingkat tertentu dan membuat air tidak berfungsi lagi sesuai dengan tujuan penggunaannya.
Air adalah pelarut yang baik, sehingga dapat melarutkan zat-zat dari batu-batuan yang berkontak dengannya. Bahan-bahan mineral yang dapat terkandung dalam air karena kontaknya dengan batu-batuan tersebut antara lain: CaCO3, MgCO3, CaSO4, MgSO4, NaCl, Na2SO4, SiO2 dan sebagainya. Dimana air yang banyak mengandung ion-ion kalsium dan magnesium dikenal sebagai air sadah. Air sadah adalah air yang di dalamnya terlarut garam-garam kalsium dan magnesium air sadah tidak baik untuk mencuci karena ion-ion Ca2+ dan Mg2+ akan berikatan dengan sisa asam karbohidrat pada sabun dan membentuk endapan sehingga sabun tidak berbuih. Senyawa-senyawa kalsium dan magnesium ini relatif sukar larut dalam air, sehingga senyawa-senyawa ini cenderung untuk memisah dari larutan dalam bentuk endapan atau precipitation yang kemudian melekat pada logam (wadah) dan menjadi keras sehingga mengakibatkan timbulnya kerak (Bintoro, 2008).
Air sadah dibagi menjadi dua yaitu air sadah sementara dan air sadah tetap. Air sadah sementara yaitu air yang kesadahannya disebabkan oleh kalsium dan magnesium dari karbohidrat dan bikarbonat, sedangkan air sadah permanen atau tetap disebutkan oleh garam kalsium sulfat dan klorida. Manfaat penentuan kesadahan sementara dan kesadahan permanen yaitu untuk mengetahui tingkat kesadahan air karena air sadah dapat menimbulkan kerak sehingga dapat menyumbat pipa saluran air panas seperti radiator yang digunakan dalam mesin-mesin pertanian.
EDTA (ethylene diamine tetraacetic) merupakan suatu kompleks kelat yang larut ketika ditambahkan ke dalam suatu larutan yang mengandung kation logam tertentu seperti Ca2+dan Mg2+, di mana akan membentuk kompleks dengan logam-logam tersebut. Ketika ditambahkan suatu indikator EBT ke dalam larutan yang mengandung kompleks tersebut maka akan menghasilkan perbahan warna pada pH tertentu, sehingga dengan prinsip ini nilai kesadahan air dapat dianalisis.
1.2 Perumusan Masalah
- Bagaimana pengertian kesadahan yang sebenarnya?
- Bagaimana metode yang dapat digunakan untuk mengukur nilai kesadahan?
1.3 Tujuan
- Mengetahui pengertian dari kesadahan
- Mengetahui metode yang dapat digunakan untuk mengukur nilai kesadahan
1.4 Manfaat
Pembuatan makalah ini diharapkan dapat memberikan informasi tentang kesadahan serta cara yang dapat digunakan untuk mengukur nilai kesadahan tersebut.
BAB II
ISI
2.1 Tinjauan Pustaka
2.1.1 Pengertian Kesadahan
Pada awalnya, kesadahan air didefinisikan sebagai kemampuan air untuk mengendapkan sabun, sehingga keaktifan/ daya bersih sabun menjadi berkurang atau hilang sama sekali. Sabun adalah zat aktif permukaan yang berfungsi menurunkan tegangan permukaan air, sehingga air sabun dapat berbusa. Air sabun akan membentuk emulsi atau sistem koloid dengan zat pengotor yang melekat dalam benda yang hendak dibersihkan.
Kesadahan terutama disebabkan oleh keberadaan ion-ion kalsium (Ca2+) dan magnesium (Mg2+) di dalam air. Keberadaannya di dalam air mengakibatkan sabun akan mengendap sebagai garam kalsium dan magnesium, sehingga tidak dapat membentuk emulsi secara efektif. Kation-kation polivalen lainnya juga dapat mengendapkan sabun, tetapi karena kation polivalen umumnya berada dalam bentuk kompleks yang lebih stabil dengan zat organik yang ada, maka peran kesadahannya dapat diabaikan. Oleh karena itu penetapan kesadahan hanya diarahkan pada penentuan kadar Ca2+ dan Mg2+. Kesadahan total didefinisikan sebagai jumlah miliekivalen (mek) ion Ca2+ dan Mg2+ tiap liter sampel air (Anonim, 2008).
Kesadahan atau hardness adalah salah satu sifat kimia yang dimiliki oleh air. Penyebab air menjadi sadah adalah karena adanya ion-ion Ca2+, Mg2+. Atau dapat juga disebabkan karena adanya ion-ion lain dari polyvalent metal (logam bervalensi banyak) seperti Al, Fe, Mn, Sr dan Zn dalam bentuk garam sulfat, klorida dan bikarbonat dalam jumlah kecil.
Air yang banyak mengandung mineral kalsium dan magnesium dikenal sebagai “air sadah”, atau air yang sukar untuk dipakai mencuci. Senyawa kalsium dan magnesium bereaksi dengan sabun membentuk endapan dan mencegah terjadinya busa dalam air. Oleh karena senyawa-senyawa kalsium dan magnesium relatif sukar larut dalam air, maka senyawa-senyawa itu cenderung untuk memisah dari larutan dalam bentuk endapan atau presipitat yang akhirnya menjadi kerak.
Pengertian kesadahan air adalah kemampuan air mengendapkan sabun, di mana sabun ini diendapkan oleh ion-ion yang saya sebutkan diatas. Karena penyebab dominan/utama kesadahan adalah Ca2+ dan Mg2+, khususnya Ca2+, maka arti dari kesadahan dibatasi sebagai sifat / karakteristik air yang menggambarkan konsentrasi jumlah dari ion Ca2+ dan Mg2+, yang dinyatakan sebagai CaCO3. Kesadahan ada dua jenis, yaitu (Giwangkara, 2008) :
- 1. Kesadahan sementara
Adalah kesadahan yang disebabkan oleh adanya garam-garam bikarbonat, seperti Ca(HCO3)2, Mg(HCO3)2. Kesadahan sementara ini dapat / mudah dieliminir dengan pemanasan (pendidihan), sehingga terbentuk encapan CaCO3 atau MgCO3.
Reaksinya:
Ca(HCO3)2 → dipanaskan → CO2 (gas) + H2O (cair) + CaCO3 (endapan)
Ca(HCO3)2 → dipanaskan → CO2 (gas) + H2O (cair) + CaCO3 (endapan)
Mg(HCO3)2 → dipanaskan → CO2 (gas) + H2O (cair) + MgCO3 (endapan)
- 2. Kesadahan tetap
Adalah kesadahan yang disebabkan oleh adanya garam-garam klorida, sulfat dan karbonat, misal CaSO4, MgSO4, CaCl2, MgCl2. Kesadahan tetap dapat dikurangi dengan penambahan larutan soda – kapur (terdiri dari larutan natrium karbonat dan magnesium hidroksida) sehingga terbentuk endapan kaslium karbonat (padatan/endapan) dan magnesium hidroksida (padatan/endapan) dalam air.
Reaksinya:
CaCl2 + Na2CO3 → CaCO3 (padatan/endapan) + 2NaCl (larut)
CaCl2 + Na2CO3 → CaCO3 (padatan/endapan) + 2NaCl (larut)
CaSO4 + Na2CO3 → CaCO3 (padatan/endapan) + Na2SO4 (larut)
MgCl2 + Ca(OH)2 → Mg(OH)2 (padatan/endapan) + CaCl2 (larut)
MgSO4 + Ca(OH)2 → Mg(OH)2 (padatan/endapan) + CaSO4 (larut)
Ketika kesadahan kadarnya adalah lebih besar dibandingkan penjumlahan dari kadar alkali karbonat dan bikarbonat, yang kadar kesadahannya eqivalen dengan total kadar alkali disebut “ kesadahan karbonat; apabila kadar kesadahan lebih dari ini disebut “kesadahan non-karbonat”. Ketika kesadahan kadarnya sama atau kurang dari penjumlahan dari kadar alkali karbonat dan bikarbonat, semua kesadahan adalah kesadahan karbonat dan kesadahan noncarbonate tidak ada. Kesadahan mungkin terbentang dari nol ke ratusan miligram per liter, bergantung kepada sumber dan perlakuan dimana air telah subjeknya.
2.1.2 EDTA
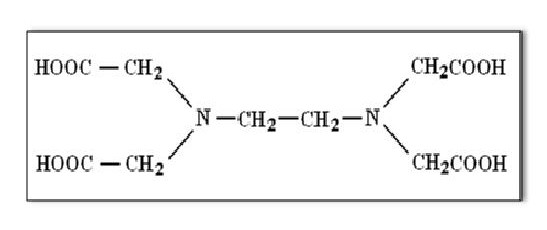
EDTA adalah kependekan dari ethylene diamin tetra acetic. EDTA berupa senyawa kompleks khelat dengan rumus molekul (HO2CCH2)2NCH2CH2N(CH2CO2H)2. Merupakan suatu senyawa asam amino yang secara luas dipergunakan untuk mengikat ion logam logam bervalensi dua dan tiga. EDTA mengikat logam melalui empat karboksilat dan dua gugus amina. EDTA membentuk kompleks kuat terutama dengan Mn (II), Cu (II), Fe (III), dan Co (III) (Anonim, 2008).
Etilendiamintetrasetat atau yang dikenal dengan EDTA, merupakan senyawa yang mudah larut dalam air, serta dapat diperoleh dalam keadaan murni. Tetapi dalam penggunaannya, karena adanya sejumlah tidak tertentu dalam air, sebaiknya distandardisasi terlebih dahulu.
Gambar 2.1 Struktur EDTA
Terlihat dari strukturnya bahwa molekul tersebut mengandung baik donor elektron dari atom oksigen maupun donor dari atom nitrogen sehingga dapat menghasilkan khelat bercincin sampai dengan enam secara serempak (Khopkar, 1990).
2.1.3 Metode Titrasi EDTA
Kesadahan total yaitu ion Ca2+ dan Mg2+ dapat ditentukan melalui titrasi dengan EDTA sebagai titran dan menggunakan indikator yang peka terhadap semua kation tersebut. Kejadian total tersebut dapat dianalisis secara terpisah misalnya dengan metode AAS (Automic Absorption Spectrophotometry) (Abert dan Santika, 1984).
Asam Ethylenediaminetetraacetic dan garam sodium ini (singkatan EDTA) bentuk satu kompleks kelat yang dapat larut ketika ditambahkan ke suatu larutan yang mengandung kation logam tertentu. Jika sejumlah kecil Eriochrome Hitam T atau Calmagite ditambahkan ke suatu larutan mengandung kalsium dan ion-ion magnesium pada satu pH dari 10,0 ± 0,1, larutan menjadi berwarna merah muda. Jika EDTA ditambahkan sebagai satu titran, kalsium dan magnesium akan menjadi suatu kompleks, dan ketika semua magnesium dan kalsium telah manjadi kompleks, larutan akan berubah dari berwarna merah muda menjadi berwarna biru yang menandakan titik akhir dari titrasi. Ion magnesium harus muncul untuk menghasilkan suatu titik akhir dari titrasi. Untuk mememastikankan ini, kompleks garam magnesium netral dari EDTA ditambahkan ke larutan buffer.
Penentuan Ca dan Mg dalam air sudah dilakukan dengan titrasi EDTA. pH untuk titrasi adalah 10 dengan indikator Eriochrom Black T (EBT). Pada pH lebih tinggi, 12, Mg(OH)2 akan mengendap, sehingga EDTA dapat dikonsumsi hanya oleh Ca2+ dengan indikator murexide. Adanya gangguan Cu bebas dari pipa-pipa saluran air dapat di masking dengan H2S. EBT yang dihaluskan bersama NaCl padat kadangkala juga digunakan sebagai indikator untuk penentuan Ca ataupun hidroksinaftol. Seharusnya Ca tidak ikut terkopresitasi dengan Mg, oleh karena itu EDTA direkomendasikan.
Kejelasan dari titik- akhir banyak dengan pH peningkatan. Bagaimanapun, pH tidak dapat ditingkat dengan tak terbatas karena akibat bahaya dengan kalsium karbonat mengendap, CaCO3, atau hidroksida magnesium, Mg(OH)2 , dan karena perubahan celup warnai di ketinggian pH hargai. Ditetapkan pH dari 10,0 ± 0,1 adalah satu berkompromi kepuasan. Satu pembatas dari 5 min disetel untuk jangka waktu titrasi untuk memperkecil kecenderungan ke arah CaCO3 pengendapan.
BAB III
METODOLOGI
3.1 Alat dan Bahan
3.1.1 Alat
Peralatan yang digunakan adalah seperangkat alat titrasi dan peralatan gelas yang biasa digunakan dalam laboratorium kimia analitik.
3.1.2 Bahan
- Larutan buffer:
1) Dilarutkan 16,9 g ammonium klorida (NH4Cl) dalam 143 mL ammonium hidroksida (NH4OH). Kemudian ditambahkan 1,25 g garam magnesium dari EDTA (yang telah distandardisasi) dan diencerkan ke dalam 250 mL aquades.
2) Jika garam magnesium dari EDTA tidak ada, dilarutkan 1,179 g garam disodium dari ethylenediaminetetraacetic aciddihydrate (reagen analitis) dan 780 mg magnesium sulfat (MgSO4 .7H2O) atau 644 mg magnesium chloride (MgCl2 . 6H2O ) ke dalam 50 mL aquades. Kemudian ditambahkan ke dalam campuran ini 16,9 g NH4Cl dan 143 mL NH4OH dengan pengadukan dan diencerkan sampai 250 mL dengan aquades.
Simpan larutan 1) atau 2) dalam suatu plastik atau gelas borosilicate. Bagikan larutan buffer menggunakan pipet. Hentikan penambahan larutan buffer ketika 1 atau 2 mL ditambahkan ke sampel tidak berhasil menghasilkan satu pH dari 10,0 ± 0,1 pada titik akhir titrasi.
3) Preparasi salah satu buffer ini dengan mencampurkan 55 mL HCl dengan aquades 400 mL dan kemudian, aduk dengan perlahan dan tambahkan 300 mL 2-aminoethanol (bebas dari alumunium dan logam lebih berat). Tambahkan 5 g garam magnesium dari EDTA dan encerkan hingga 1 L dengan aquades.
- Agen Complexing:
Adakalanya air mengandung ion yang bertentangan memerlukan penambahan suatu agen complexing yang sesuai untuk memberikan satu titik akhir, yaitu perubahan warna yang tajam pada titik-akhir. Berikut adalah agen complexing tersebut:
1) Inhibitor I : Sesuaikan sampel asam ke pH 6 atau lebih tinggi dengan larutan buffer atau 0,1 N NaOH. Tambahkan 250 mg NaCN (bentuk serbuk). Tambahkan buffer secukupnya untuk menyesuaikan ke pH 10,0 ±0,1 (AWAS: NaCN adalah sangat beracun).
2) Inhibitor II. : Larutkan 5 g sulfida sodium nonahydrate (Na2S + 9 H2O) atau 3,7 g Na2S + 5H2O dalam 100 mL aquades.
3) MgCDTA : garam magnesium dari 1, 2-cycclohexanediamine tetraacetic asam. Tambahkan 250 mg per 100 mL sampel dan larutkan sebelum menambahkan larutan buffer.
- Indikator:
Banyak jenis dari larutan indikator telah diakui dan mungkin dipergunakan kalau ahli analisa mempertunjukkan bahwa mereka menghasilkan nilai akurat. Kesulitan utama dengan larutan indikator adalah kerusakan oleh waktu, dimana berakibat memberikan titik akhir yang tidak jelas. Sebagai contoh, larutan alkalin dari Eriochrome Black T sensitif terhadap oksidasi dan mengandung air atau larutan alkohol adalah tidak stabil.
1) Eriochrome Black T (EBT): Garam sodium dari asam 1-(1-hydroxy-2-naphthylazo)-5-Nitro-2-naphthol-4-sulfonic. Larutkan 0,5 g pada 100 g 2,2’,2”-nitrilotriethanol (juga disebut triethanolamine) atau 2- methoxymethanol (juga disebut Ether ethylene glycol monomethyl). Tambahkan 2 tetes per 50 mL larutan untuk di titrasi.
2) Calmagite: Asam 1-(1-hydroxy-4-metil-2-phenylazo)-2-naphthol-4-sulfonic. Senyawa ini bersifat stabil di larutan air dan menghasilkan perubahan warna yang sama seperti Eriochrome Black T. Larutkan 0.10 g Calmagite pada 100 mL aquades. Gunakan 1 mL per 50 mL larutan untuk di titrasi. Sesuaikan volume kalau perlu.
3) Indikator 1 dan 2 dapat digunakan dalam bentuk serbuk kering untuk menghindari kelebihan indikator. Dipersiapkan campuran kering dari indikator ini dan satu garam inert tersedia secara komersial.
Jika warna titik akhir dari indikator ini tidak jelas dan tajam, ini biasanya memaksudkan bahwa satu agen complexing yang sesuai diperlukan. Kalau inhibitor NaCN tidak menunjukan ketajaman pada titik akhir, mungkin indikator dalam keadaan tidak baik.
- EDTA Titrant standar, 0,01 M :
Timbang 3.723 g disodium ethylenediaminetetraacetate dihydrate, juga disebut dengan etilendiamintetraasetat (EDTA), larutkan di dalam aquades, dan diencerkan pada 1000 mL. Standarkan dengan larutan kalsium standar (2e) sebagaimana diuraikan dalam pada 3b di bawah.
Karena titran mengekstrak kation dan menghasilkan kesadahan dari wadah gelas plastik, maka lebih baik simpan di polyethylene atau gelas botol borosilicate.
- Larutan Kalsium standar :
Ditimbang 1,000 g serbuk CaCO3 anhidrat ke dalam satu 500 mL Erlenmeyer. tambahkan secara perlahan 1+1 HCL hingga semua CaCO3 telah larut. Tambahkan 200 mL aquades dan aduk untuk beberapa menit untuk mengusir CO2 . Tambahkan beberapa tetes dari indikator metil merah, dan tambahkan 3N NH4OH atau 1+1 HCL hingga larutan berwarna orange, seperti yang diperlukan. Encerkan ke dalam 1000 mL dengan aquades; 1 mL = 1.00 mg CaCO3 .
f. Natrium hidroksida, NaOH, 0. 1 N.
3.2 Prosedur Kerja
- a. Pembuatan air limbah dan air limbah sampel :
Digunakan asam nitrat-asam sulfat atau asam nitrat- asam perchloric encer.
- b. Titrasi dari sample :
Pilih satu volume sampel yaitu yang kurang dari 15 mL EDTA titrant dan dititrasi selama 5 menit, diukur dari waktu dari penambahan buffer.
Encerkan 25.0 mL sampel ke dalam 50 mL aquades didalam kaserol porselin atau wadah lain yang sesuai. Tambahkan 1-2 mL larutan buffer. Biasanya 1 mL akan cukup untuk memberikan pH dari 10.0 ke 10.1. Munculnya satu warna titik-akhir yang tajam didalam titrasi biasanya diartikan bahwa satu inhibitor harus ditambahkan dalam titik ini.
Tambahkan 1-2 tetes larutan indikator atau formulasi indikator secukupnya. Tambahkan standar EDTA Titrant perlahan-lahan, dengan pengadukan, hingga warna kemerah-merahan hilang. Tambahkan beberapa tetes indikator pada rentang 3 sampai 5. Pada titik akhir secara normal akan muncul warna biru. Cahaya matahari dan cahaya dari lampu fluoresen sangat dianjurkan karena cahaya-cahaya tersebut dapat menunjukkan titik-titik berwarna merah pada larutan yang berwarna biru pada saat titik akhir titrasi.
Jika sampel cukup ada tersedia dan pengganggu tidak ada, tingkatkan keakuratan dengan meningkatkan ukuran sampel, sebagaimana diuraikan pada poin c di bawah.
- c. Sampel dengan kesadahan rendah :
Untuk air dengan kesadahan rendah (kurang dari 5 mg / L), ambil suatu sampel dalam jumlah yang besar, 100-1000 mL, untuk dititrasi dan ditambahkan dengan sejumlah besar inhibitor, buffer, dan indikator. Tambahkan larutan standar EDTA titrant perlahan-lahan dari satu microburet dan dimulai dari blanko, gunakan air yang telah di destilasi, didestilasi ulang atau air yang telah diionisasi dari volume yang sama dengan sampel, dimana sejumlah serupa dari larutan buffer, inhibitor, dan indikator telah ditambahkan sebelumnya. Ambil beberapa volume dari EDTA untuk blanko dari volume dari EDTA yang digunakan untuk sampel.
3.3 Perhitungan
Kesadahan (EDTA) seperti mg CaCO 3 /L = (A x B X 1000)/ mL sampel
Dimana:
A = mL untuk sampel dan
B = mg CaCO 3 ekivalen dengan 1.00 mL EDTA titrant.
BAB IV
PEMBAHASAN
Prosedur umum untuk awal percobaan ini dengan satu contoh air mengandung mineral yang berisi kalsium dan magnesium. Untuk mengasuransikan bahwa semua kation tinggal di dalam solusi dan itu pekerjaan indikator dengan baik, satu penyangga biasanya menyesuaikan pH ke 9.9 10.1. Setelah pH disesuaikan dan indikator ditambahkan, EDTA Titrant ditambahkan melalui satu buret.
EDTA adalah satu agen chelating itu dapat mendonorkan elektron (Aturan Lewis) yang kemudian akan membentuk satu kompleks dengan ion logam (Asam Lewis). EDTA pertama kali akan membentuk kompleks dengan Ca2+ dan kemudian dengan Mg2+. Seperti pada titrasi apapun kita akan perlu satu indikator untuk menentukan ketika semua Ca2+ dan Mg2+telah membentuk kompleks dengan EDTA (titik akhir titrasi). Indikator yang dipergunakan di percobaan ini adalah Eriochrome Hitam T. Di pH 10 indikator akan berada di dalam bentuk HInd2- (Ind mewakili indikator), dan menghasilkan kompleks berwarna biru. Selanjutnya pada saat indicator bereaksi dengan Mg2+ akan memberikan satu kompleks merah.
Pertama EDTA (H2Y2-) akan kompleks dengan ion kalsium, membentuk satu kompleks merah:
1) H2In- + Ca2+ CaIn- + 2H+
Pada titik akhir, EDTA akan kompleks dengan kalsium dan indikator menjadi lepas, yaitu ditandai oleh warna merah berganti warna biru:
2) EDTA + CaIn- + 2H+ H2In- + CaEDTA
(merah) (biru)
BAB V
PENUTUP
5.1 Kesimpulan
- Kesadahan merupakan sifat kimia yang dimiliki air dimana, terdapat ion-ion yang menyebabkan sabun sulit menghasilkan busa terutama ion Ca2+ dan Mg2+. Dimana Kesadahan total didefinisikan sebagai jumlah miliekivalen (mek) ion Ca2+ dan Mg2+ tiap liter sampel air.
- Salah satu metode yang dapat digunakan untuk mengukur nilai kesadahan pada air adalah dengan metode titrasi EDTA.
DAFTAR PUSTAKA
Anonim, 2008, Water Hardness: EDTA Titrimetric Method, New York USA
Albert dan Santika, Sri Sumestri, 1984, Metode Penelitian Air, ITS Press, Surabaya
Bintoro, 2008, Penentuan Kesadahan Sementara dan Kesadahan Permanen, http://aabin.blogsome.com
Giwangkara, E., 2008, http://persembahanku.wordpress.com/2006/09/29/mengapa mandi dipantai boros sabun
Khopkar, S. M., 1990, Konsep Dasar Kimia Analitik, Penerjemah : A. Saptorahardjo, UI-Prees, Jakarta.






0 komentar:
Posting Komentar